Autophagie verstehen – Schlüssel zu gesunder Alterung und langem Leben
Der wissenschaftliche Hintergrund dieses zellulären Phänomens und häufige Missverständnisse.

Kundenservice
Da Menschen heute immer älter werden, stellt sich die Frage: Wie alt kann der Mensch maximal werden? Welche Prozesse in unserem Körper erhöhen die Wahrscheinlichkeit, ein besonders hohes Alter zu erreichen? Antworten auf diese und viele weitere spannende Fragen zu den Themen Alterung, Langlebigkeit und Autophagie finden Sie im folgenden Beitrag!
Obwohl es in den letzten Jahren globale Herausforderungen wie Kriege, Pandemien oder Naturkatastrophen gab, leben wir heute unter den komfortabelsten Bedingungen, die die Menschheit je erlebt hat. Während der Großteil unserer Geschichte vom täglichen Überlebenskampf geprägt war, können wir uns heute mit Themen wie Langlebigkeit und gesundem Altern auseinandersetzen.
In unserer neuen Kolumne erfahren Sie mehr über dieses faszinierende Thema, über Autophagie und andere zelluläre Prozesse sowie über aktuelle wissenschaftliche Erkenntnisse.
Themenübersicht:
- Lebensdauer
- Statistiken zur Langlebigkeit
- Die Wissenschaft der Langlebigkeit
- Was bedeutet Langlebigkeit überhaupt?
- Autophagie und andere zelluläre Prozesse im Zusammenhang mit Langlebigkeit
- Was ist Autophagie?
- Wie kann Autophagie die Lebensdauer verlängern?
- Wann und unter welchen Bedingungen findet Autophagie im menschlichen Körper statt?
- Wie lange sollte man fasten?
- Nach wie vielen Stunden beginnt die Autophagie?
- Wie lässt sich die Makroautophagie beschleunigen?
- Fazit – Wie und wann sollte man fasten?
Erste Frage – lässt sich die menschliche Lebensdauer verlängern?
Laut der Evolutionstheorie von Charles Darwin werden jene Merkmale einer Art – auch beim Homo sapiens – weitervererbt, die den Fortpflanzungserfolg maximieren. Das Überleben nach der Reproduktionsphase spielte für die Evolution dabei hingegen kaum eine Rolle. Und doch zeigen Statistiken: Die durchschnittliche Lebenserwartung des Menschen steigt von Jahrzehnt zu Jahrzehnt. Was geschieht also wirklich – verändern wir uns selbst oder wandelt sich unsere Umwelt?
Wir können die Genetik nicht allzu sehr für den beobachteten signifikanten Anstieg der Lebenserwartung verantwortlich machen, ebenso wenig, wie wir sie beispielsweise für die globale Adipositas-Pandemie in der modernen Bevölkerung verantwortlich machen können und sollten. Gene verändern sich, wenn überhaupt, nur sehr langsam und können daher unmöglich ein signifikanter Faktor sein. Das Thema Adipositas ist jedoch eine ganz andere Geschichte.
Kehren wir nun zur Langlebigkeit zurück! Als „Echo“ des wissenschaftlichen und industriellen Fortschritts der Zivilisation war das 20. Jahrhundert eine beispiellose Periode in der Geschichte. Dies zeigt sich besonders deutlich im Zusammenhang mit der stetigen Verbesserung menschlicher Fähigkeiten und Leistungen, dem signifikanten Anstieg der durchschnittlichen Lebenserwartung und anthropologischen Erkenntnissen. Beispiele hierfür sind das Wachstum der durchschnittlichen Körpergröße bei Erwachsenen und die Verschiebung der maximalen physiologischen Leistungsfähigkeit..
Was den Anstieg der Lebenserwartung im letzten Jahrhundert betrifft, zeigen Analysen historischer Daten jedoch eine deutliche Verlangsamung. Wissenschaftler prognostizieren, dass die in den 2000er Jahren geborene Generation die erste in der Geschichte der Menschheit sein wird, die kürzer lebt als ihre Vorfahren. Trotz aller Fortschritte in Wissenschaft, Technologie und Medizin könnte der rasante Anstieg von Fettleibigkeit bei Kindern (sofern er nicht gestoppt wird) die durchschnittliche Lebenserwartung der Bevölkerung in den westlichen Ländern um bis zu fünf Jahre verkürzen.
Dieses Phänomen hat in verschiedenen Fachrichtungen der akademischen Welt zu intensiven und leidenschaftlichen Debatten geführt. Dabei steht vor allem eine Frage im Raum: Handelt es sich bei den aktuellen Beobachtungen um das tatsächliche Erreichen unserer biologischen Obergrenze in Bezug auf die Lebensspanne – oder leben wir schlichtweg ungesünder und vernachlässigen zunehmend unsere Stoffwechselgesundheit?
Wie auch immer die Antwort lautet – die Zeit wird es zeigen. Bis dahin lohnt es sich, einen genaueren Blick auf bestimmte statistische Kennzahlen und biologische Prozesse zu werfen, die mit einer möglichen Lebensverlängerung in Zusammenhang stehen und die erst durch den Fortschritt von Industrie und Langlebigkeitsforschung in unser Blickfeld gerückt sind.

Langlebigkeitsstatistiken in verschiedenen Ländern
In einer in der Fachzeitschrift PNAS veröffentlichten Studie analysierten Vaupel und Kollegen Daten der Human Mortality Database (HMD) und untersuchten insbesondere die Sterbewahrscheinlichkeit in einem bestimmten Alter. In verschiedenen Ländern, darunter den USA, Schweden und Japan, verzögerte sich die Sterblichkeit von Menschen über 50 Jahren zwischen 1967 und 2017 in jeder Altersgruppe (50er, 60er, 70er usw.) um durchschnittlich ein ganzes Jahrzehnt.
In Schweden blieb die Sterblichkeitsrate während des 19. und frühen 20. Jahrhunderts weitgehend stabil, bis etwa 1950 eine sogenannte „internationale Revolution der Lebenserwartung” einsetzte. Dieser plötzliche Wandel ist hauptsächlich auf den enormen medizinischen Fortschritt nach dem Zweiten Weltkrieg zurückzuführen: von der Entdeckung der DNA-Struktur über die Entwicklung neuer Impfstoffe und Medikamente bis hin zur ersten erfolgreichen Nierentransplantation und der Erfindung des Herzschrittmachers.
Seitdem steigt die Lebenserwartung weltweit nahezu linear an, und zwar um durchschnittlich 2,5 Jahre pro Jahrzehnt. Ein ähnlicher Trend lässt sich auch in Japan beobachten, dem Land mit der weltweit höchsten Lebenserwartung. Der entscheidende Grund dafür ist die verzögerte Sterblichkeit: Menschen leben heute länger (eng. lifespan), weil sie gesünder altern (eng. healthspan). Altersbedingte Krankheiten treten später auf oder entwickeln sich langsamer, was zu einer verlängerten Lebens- und Gesundheitsspanne führt.
Heute ist die Bevölkerung – insbesondere in Industrieländern – gleichmäßiger über alle Altersgruppen verteilt. Dies ist unter anderem dem verbesserten Zugang zu medizinischer Versorgung sowie dem gestiegenen Bewusstsein für Gesundheit und Prävention, vor allem gegen Ende des 20. Jahrhunderts, zu verdanken.
Doch je länger wir leben, desto drängender wird die Frage: Wie alt können Menschen eigentlich werden? Der Langlebigkeitsforscher G. Kletetschka verweist in diesem Zusammenhang gerne auf den Grönlandwal, der mit einer Lebenserwartung von bis zu 211 Jahren als das langlebigste bekannte Säugetier gilt. Und was ist mit uns Menschen? Der bisherige Rekord liegt bei der Französin Jeanne Calment, die 1997 im Alter von beeindruckenden 122 Jahren verstarb – ein bis heute unerreichter Meilenstein in der Geschichte der Zivilisation.
Was sagt die Wissenschaft über Langlebigkeit aus?
Nach Analyse der oben genannten Daten behaupten einige Forscher, dass die maximale menschliche Lebenserwartung bereits erreicht sei oder gerade dabei sei, ihr Plateau zu erreichen. Andere Wissenschaftler sind jedoch anderer Meinung. Sie glauben, dass noch nicht genug Zeit vergangen ist, um Jeannes Rekord zu brechen. Schließlich sind neue Erkenntnisse und Praktiken, die potenziell die Langlebigkeit fördern, erst kürzlich bekannt geworden und sogar umgesetzt worden.
Es gibt drei vorherrschende Ansichten unter Langlebigkeitsforschern, die über die Zukunft der Lebenserwartung spekulieren:
- Die Lebenserwartung wird zwar steigen, jedoch langsamer als in der Vergangenheit, da biologische Grenzen erreicht sind.
- Der Anstieg um 2,5 Jahre pro Jahrzehnt wird sich fortsetzen.
- Aufgrund biomedizinischer Fortschritte wird die Lebenserwartung jedoch deutlich schneller steigen, ähnlich wie in den 1950er Jahren.
Eine wirksamere Strategie im Bereich der öffentlichen Gesundheit – wir haben und sehen weiterhin viele Misserfolge bei der Kontrolle und Behandlung von Krankheiten, beispielsweise bei der letzten Pandemie – sowie die Entwicklung wirksamerer Behandlungen für altersbedingte Krankheiten wie Demenz und Krebs würden die derzeitigen Grenzen von Gesundheit und Lebensspanne verschieben. Darüber hinaus könnten die Entwicklung der Präzisionsmedizin, der Nanotechnologie und der Geweberegeneration sowie zusätzliche Forschung zur Biologie des Alterns künftig zu einer Verlangsamung des Alterungsprozesses und damit zu einer Verlängerung von Leben und Gesundheit führen.
Andererseits sollten wir ehrlich sein: Nicht alles, was mit menschlicher Langlebigkeit zu tun hat, ist so einfach, wie es auf den ersten Blick scheint. Ereignisse auf globaler Ebene können passieren, die die Lebenserwartung tatsächlich verringern. Neue Krankheiten, Kriege, der bereits erwähnte Anstieg der Fettleibigkeit bei einem wachsenden Teil der Bevölkerung sowie ein sitzender Lebensstil sind ernsthafte Risikofaktoren für die Lebenserwartung. Doch nicht alles ist so düster! Herausfordernde Zeiten waren schon immer ein Motor für wissenschaftliche Innovation – das zeigen eindrucksvoll frühere Weltkriege und Epidemien..
Nach dieser ausführlichen Einleitung und einigen Statistiken kommen wir nun zum Thema dieser Kolumne: dem Phänomen der Langlebigkeit. Welche Prozesse in unserem Körper können die Wahrscheinlichkeit erhöhen, dass wir ein hohes Alter erreichen und – noch wichtiger – in vitaler körperlicher Verfassung bleiben?
Langlebigkeit bedeutet nicht nur eine zeitliche Verlängerung des Lebens. Es ist bedeutungslos, wenn wir die letzten x Jahre machtlos und unbeweglich waren. „Wahre“ Langlebigkeit bedeutet, bis zum letzten Moment körperlich und geistig bereit zu sein, am Leben teilzunehmen.
Was genau ist Langlebigkeit?
Langlebigkeit bezeichnet die Fähigkeit, Vitalität sowie körperliche und geistige Leistungsfähigkeit über einen außergewöhnlich langen Zeitraum hinweg zu bewahren – häufig sogar über die durchschnittliche Lebensspanne hinaus. Das Streben nach Langlebigkeit zielt somit nicht nur auf ein längeres Leben, sondern auch auf den Erhalt oder die Steigerung der Lebensqualität in diesen zusätzlichen Jahren ab. Es lässt sich treffend mit dem Leitsatz „Dem Leben Jahre und den Jahren Leben schenken“ zusammenfassen.
Langlebigkeit steht für das Bestreben, Jugendlichkeit und Vitalität zu fördern oder zu erhalten, indem der natürliche Alterungsprozess gezielt verlangsamt wird. Die Forschung auf diesem Gebiet ist beim Menschen noch vergleichsweise jung und zum Teil spekulativ. Im Zentrum des Interesses steht dabei ein besonders faszinierender Mechanismus – die Autophagie. Mehr über diesen und andere Prozesse erfahren Sie im weiteren Verlauf.
Die Langlebigkeitsforschung begann mit Experimenten an Hefen, Fadenwürmern (C. elegans) und Fruchtfliegen (Drosophila), da diese einen kurzen Lebenszyklus haben.
Um Schwankungen der menschlichen Lebensspanne zu untersuchen, sind 80 bis 90 Jahre völlig unpraktisch, während die 90-tägige Lebensdauer von C. elegans sich sehr gut für erste Langlebigkeitsstudien eignet. Sobald die entsprechenden Mechanismen in diesen kürzeren Forschungsmodellen etabliert sind, werden Studien an geeigneten Säugetierarten wie Mäusen und Ratten durchgeführt. Studien am Menschen gibt es aus den bereits genannten praktischen Gründen nicht. Wir leben nicht in einem Labor oder Käfig und sind ungleich komplexere Wesen als die oben genannten Tiere.
Aus den genannten Studien und Tierversuchen lassen sich zwar wertvolle Erkenntnisse und Zusammenhänge ableiten, die jedoch nicht eins zu eins auf den Menschen übertragbar sind. Die zugrunde liegenden Mechanismen sowie der zeitliche Ablauf zellulärer Prozesse wie der Autophagie unterscheiden sich teils erheblich.
Untersuchungen zur menschlichen Langlebigkeit zeigen jedoch eindeutig: Eine an den Lebensstil angepasste Ernährung, ein gesundes Körpergewicht bzw. ein ausgewogener Körperfettanteil bei gleichzeitiger Erhaltung von Muskelmasse und Kraft sowie stabile soziale Beziehungen sind entscheidend für gesundes Altern und ein langes, vitales Leben.
Es ist klar, dass Übergewicht und Fettleibigkeit das Risiko vieler chronischer Krankheiten erhöhen, die die Lebenserwartung verkürzen und die Gesundheit gefährden, darunter Typ-2-Diabetes, Herz-Kreislauf-Erkrankungen und Schlaganfälle.
Es gibt also keinen Trick oder Zauber, der Ihr Leben effektiver verlängert, als die Reduzierung der Fettmasse bzw. des Körperfettanteils. Sobald Sie Ihren Fettanteil in den „gesunden“ Bereich gebracht haben (bei Männern unter 20 %, bei Frauen in der Regel unter 30 %), ist es sinnvoll, nach weiteren Möglichkeiten zur Verbesserung der Langlebigkeit zu suchen. Alles andere wäre „Schulschwänzen“.
Betrachten wir jedoch, was wir aus der Langlebigkeitsforschung bei Labortieren gelernt haben und in unserem Leben anwenden können, um unsere Chancen auf ein gesundes Leben zu erhöhen!
Autophagie und andere zelluläre Phänomene im Zusammenhang mit Langlebigkeit
Es gibt (mindestens) fünf zelluläre Phänomene, die mit der Verlängerung der Lebensdauer in Zusammenhang stehen.
1. Zelluläre Seneszenz (Altern)
Zelluläre Seneszenz bezeichnet die Alterung einer einzelnen Zelle, die sich durch phänotypische und metabolische Veränderungen äußert und zu einer Verlangsamung oder einem kompletten Stopp ihrer Funktion führt. Die Ansammlung seneszenter Zellen scheint zu altersbedingten Pathologien beizutragen. In Versuchstieren konnte gezeigt werden, dass die Entfernung seneszenter Zellen diese pathologischen Veränderungen rückgängig macht.
Mit zunehmendem Alter verliert eine Zelle nach und nach ihre Form, ihre Funktionen und ihre Leistungsfähigkeit. Aus physikalischer Sicht steigt dabei die Entropie, also das Maß an Unordnung, innerhalb der Zelle. In diesem „ungeordneten“ Zustand beginnt die Zelle, entzündungsfördernde Moleküle auszuschütten. Diese begünstigen stille, chronisch-systemische Entzündungen, welche den Alterungsprozess des gesamten Organismus beschleunigen können.
Bemerkenswert ist, dass sich solche unterschwelligen Entzündungen durch klassische Entzündungsmarker wie den CRP-Wert meist nicht erkennen lassen.
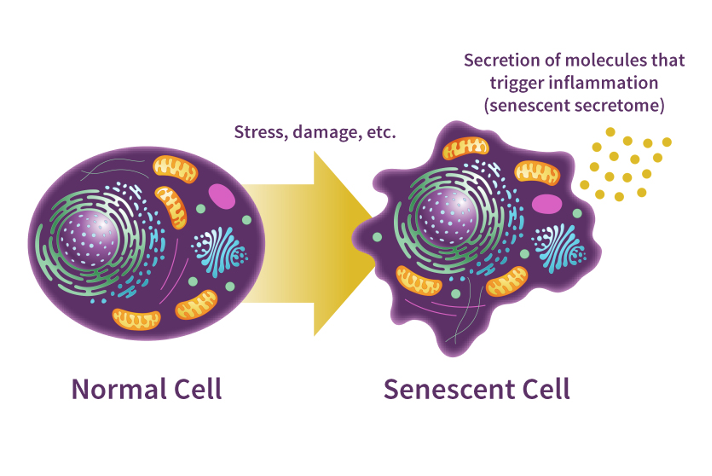
Mit zunehmendem Alter nimmt die Anzahl seneszenter Zellen im menschlichen Körper zu. Da das Immunsystem mit zunehmendem Alter an Leistungsfähigkeit verliert, können sich seneszente Zellen ungehindert vermehren. Dies schwächt die Widerstandskraft des Körpers gegenüber Stress, Infektionen und Krankheiten und kann zudem die Regeneration nach Verletzungen beeinträchtigen. Auch die kognitive Leistungsfähigkeit des Gehirns kann durch diese Zellen negativ beeinflusst werden.
Zelluläre Seneszenz wird daher mit einer Vielzahl altersbedingter Erkrankungen in Verbindung gebracht, darunter Krebs, Diabetes, Osteoporose, Herz-Kreislauf-Erkrankungen, Schlaganfall, Alzheimer und andere Demenzformen sowie Arthrose. Darüber hinaus gehen diese Prozesse häufig mit einem schleichenden Rückgang des Sehvermögens, der Beweglichkeit und der geistigen Klarheit einher.
Zahlreiche aktuelle Studien widmen sich daher der Erforschung der Rolle und des Einflusses seneszenter Zellen im Alterungsprozess.
2. Hormesis
Hormesis wird üblicherweise als eine positive oder stimulierende Wirkung definiert, die durch die Exposition gegenüber niedrigen Dosen eines Wirkstoffs verursacht wird, der in höheren Dosen bekanntermaßen toxisch ist. Konzeptionell wird dies durch eine U-förmige Dosis-Wirkungs Kurve für Toxizität dargestellt: Die hormetischen Effekte nehmen nach einem Maximum mit steigender Dosis ab, danach nimmt die Toxizität zu. Wie in der Abbildung zu sehen ist, gibt es innerhalb der hormetischen Zone im Allgemeinen eine günstige biologische Reaktion auf eine geringe Belastung mit Toxinen und anderen Stressoren.
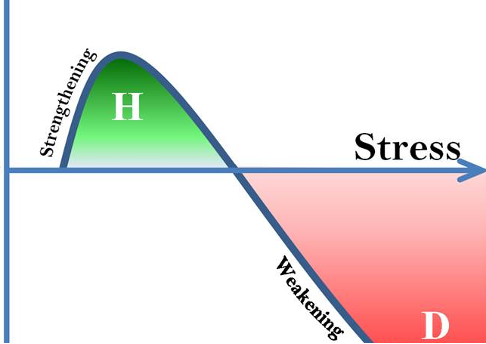
Hormetische Reaktionen werden in der Literatur seit dem späten 19. Jahrhundert beschrieben. Der Begriff „Hormesis” wurde in den 1940er Jahren erstmals von Southman und Ehrlich verwendet, um die moderate stimulierende Wirkung eines bestimmten Pflanzenextrakts in geringen Mengen im Vergleich zu dessen zerstörerischer Wirkung in hohen Mengen zu beschreiben.
Experimentelle Ergebnisse deuten darauf hin, dass es mehrere andere Verbindungen gibt, die geringfügige Schäden an Mitochondrien verursachen, jedoch die Lebensdauer verlängern. Hormesis steht im Zusammenhang mit der Expression von Immunzellen, die auf Stressreize wie Zytokine, UV-Strahlung, Hitze (Sauna) oder Kälte (Eisbäder) reagieren.
Zusammenfassend lässt sich sagen, dass geringe Dosen toxischer Substanzen und/oder Bedingungen nachweislich die Abwehr- und Reparatursysteme des Körpers stimulieren.
3. Was ist Autophagie – und welchen Einfluss hat sie auf die Lebensdauer?
Dieser Begriff wurde durch die Verleihung des Nobelpreises an den japanischen Wissenschaftler Yoshinori Ohsumi im Jahr 2016 einem breiteren Publikum bekannt. Er erhielt die Auszeichnung für seine Entdeckungen zum Phänomen der Autophagie in Hefezellen.
Autophagie ist ein Oberbegriff für alle Prozesse, bei denen Zellmaterialien in den zellulären „Recyclingbehälter“, das Lysosom in tierischen und menschlichen Zellen bzw. die Vakuole in Pflanzen- und Hefezellen, gelangen. Es gibt drei Klassen von Autophagie:
- Makroautophagie und
- Mikroautophagie (nur in Pflanzenzellen).
- Autophagie, die durch Chaperonproteine vermittelt wird.
Die Makroautophagie gilt als Haupttyp der Autophagie und ist am besten erforscht. Daher wird die Makroautophagie auch einfach als „Autophagie” bezeichnet.
Die Autophagie ist ein hoch regulierter Prozess der gezielten Zellreinigung und fungiert somit als eine Art Qualitätssicherung auf zellulärer Ebene. Dabei werden beschädigte oder nicht mehr funktionsfähige Zellbestandteile abgebaut und recycelt. Bei Säugetieren unterscheidet man vor allem zwischen der Makroautophagie, der Hauptform dieses Prozesses, und der chaperonvermittelten Autophagie (CMA).
Chaperonproteine spielen eine zentrale Rolle bei der Bildung und korrekten Faltung von Proteinen. Sie sind an der Strukturierung von über der Hälfte aller Proteine im Säugetierorganismus beteiligt. Während der Proteinfaltung wird eine lineare Proteinkette in eine spezifische, dreidimensionale Struktur überführt. Dies ist ein entscheidender Schritt, damit das Protein seine biologische Funktion erfüllen kann.
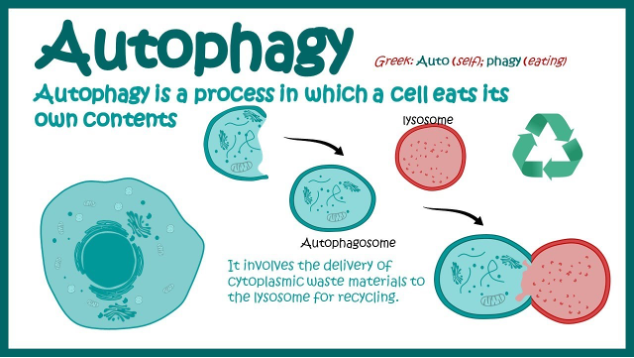
Wie kann Autophagie die Lebensdauer verlängern?
Ein offensichtlicher Mechanismus ist die zellautonome Funktion der Autophagie. Diese verhindert die Ansammlung toxischer Proteine (z. B. fehlgefalteter oder aggregationsanfälliger Proteine) und Organellen.
Darüber hinaus kann Autophagie die Sekretion von Entzündungsmolekülen, den sogenannten Zytokinen, sowie die spontane Entstehung von Tumoren reduzieren. Dies könnte ihre lebensverlängernde Wirkung erklären.
Ein gemeinsames Merkmal aller gealterten Zellen (Punkt 1 – Seneszenz) ist die fortschreitende Ansammlung geschädigter Proteine und Organellen, beispielsweise defekter Mitochondrien. Eine verminderte Autophagieaktivität könnte für diesen Prozess von Bedeutung sein.
Frühe Studien haben gezeigt, dass die Autophagiefunktion sowohl bei Nagetieren als auch bei isolierten menschlichen Zellen mit zunehmendem Alter abnimmt. Eine Analyse hat außerdem gezeigt, dass Kalorienrestriktion – die einzige bekannte Maßnahme zur effektiven Verlangsamung des Alterungsprozesses – den Rückgang der Autophagieaktivität mit zunehmendem Alter verhindert. Je älter wir werden, desto sinnvoller erscheint es, Nahrungsfasten als Intervention einzusetzen, um den im Laufe der Jahre geschwächten Prozess der Autophagie zu beschleunigen.
Wenn man jünger als beispielsweise 30 Jahre ist, muss man sich damit nicht befassen, denn für solche Eingriffe bleibt im Laufe des Lebens Zeit. Betrachten wir, wie oft und wie lange man fasten sollte, um wahrscheinlich von den Langlebigkeitseffekten des Autophagieprozesses zu profitieren.
Wann und unter welchen Bedingungen findet Autophagie im menschlichen Körper statt?
Alle Lebewesen erneuern sich ständig. Daher werden auch beim Menschen Zellen und intrazelluläre Bestandteile neu angeordnet und recycelt. Teilweise, um alte Bestandteile durch frische und qualitativ bessere zu ersetzen. Die Antwort auf die Frage lautet also: ständig – solange wir leben, unabhängig davon, ob wir gegessen haben oder nicht!
Die Einschränkung verschiedener Faktoren wie Aminosäuren und/oder die Gesamtenergieaufnahme mit der Nahrung sowie die Sauerstoffverfügbarkeit können die Autophagie beschleunigen.
Unter allen Nährstoffen induziert die Einschränkung von Stickstoff oder Aminosäuren (Proteinen) in der Nahrung das höchste Maß an Autophagie, sowohl in Hefen als auch in kultivierten Säugetierzellen. Dies ist durchaus sinnvoll, da die Hauptprodukte der Autophagie Aminosäuren sind, die aus Zellproteinen gewonnen werden. Solange über die Nahrung Energie bzw. Aminosäuren aufgenommen werden, werden diese nicht produziert.
Dieser Prozess wird durch Proteine, die mit der Autophagie in Zusammenhang stehen, vermittelt. Bislang wurden über 30 dieser Proteine identifiziert. Er kann sowohl bei einem Kalorienüberschuss als auch bei einem Kaloriendefizit auftreten:
- Bei Nährstoffmangel (Fasten) ist die Autophagie nicht selektiv und zielt darauf ab, Zellen mit einem Energiesubstrat zu versorgen.
- Während wir ernährt werden, zielen spezifische Proteine auf beschädigte Organellen ab, um sie zu entfernen. Je jünger wir sind, desto effizienter und schneller funktioniert dieser Prozess.
Zusammenfassend lässt sich sagen, dass die Autophagie im Körper aller Säugetiere, einschließlich des Menschen, ständig stattfindet. Je höher der Proteingehalt in der Ernährung, desto später beschleunigt sich der Prozess. Ausgelöst wird er in der Regel durch vollständigen Nahrungsmangel. Jeder Bissen setzt den „Autophagie-Zähler” auf 0 zurück.
Wie lange sollte man fasten, um signifikante autonome Effekte zu erzielen?
Selbst bei Menschen mit geringer Proteinzufuhr wird die Autophagie während kurzer Fastenperioden von unter 24 Stunden nicht nennenswert aktiviert. Es wird vermutet, dass die „echte“ autonome Wirkung frühestens nach etwa 36 Stunden einsetzt, auch wenn dieser Zeitpunkt beim Menschen bisher nicht direkt nachgewiesen werden konnte. Eine proteinreiche Ernährung verzögert diesen Effekt zusätzlich.
Es ist also an der Zeit, mit einem der häufigsten Missverständnisse rund um das Thema Autophagie aufzuräumen: Selbst bei regelmäßiger Anwendung von Fastenformen wie der 16:8-Methode findet im Körper nicht automatisch eine relevante Autophagie statt – zumindest nicht in dem Ausmaß, wie oft behauptet wird.
4. Mitophagie
Mitochondrien sind erstaunliche Bewohner unserer Zellen. Kleine Kraftwerke, die uns tatsächlich am Laufen halten. Mitophagie ist eine auf Mitochondrien anwendbare Form der Autophagie. Sie ist notwendig, um die Qualität, Form und Funktion der Mitochondrien durch das Recycling beschädigter Mitochondrien zu erhalten. Sie wird entweder durch Mikro- oder Makro-Mitophagie durchgeführt. Während bei Säugetieren nur der letztgenannte Prozess beteiligt zu sein scheint, sind bei den untersuchten Hefen beide aktiv.
Hefezellen, denen die Makromitophagie fehlt, weisen vergrößerte, rundliche Mitochondrien mit verkürzten Cristae auf. Ein Mangel an Mitophagie führt besonders unter Bedingungen der Kalorienrestriktion zur Ansammlung funktionsunfähiger Mitochondrien.
Cristae sind Einstülpungen der inneren Mitochondrienmembran. Ihr Name stammt vom lateinischen Wort für „Kamm“ oder „Grat“. Sie verleihen der Membran ihre typische gefaltete Struktur und vergrößern so die Oberfläche für lebenswichtige chemische Reaktionen.
Die Mitophagie, also das gezielte Recycling defekter Mitochondrien, ist daher essenziell für eine langfristig stabile und effiziente Zellfunktion.
5. Chaperon-vermittelte Autophagie – Nach wie vielen Stunden beginnt die Autophagie?
Die dritte Art der Autophagie ist die chaperonvermittelte Autophagie (CMA).
Wie andere autophagische Prozesse wird auch die CMA durch zellulären Stress und Kalorienrestriktion aktiviert. Insbesondere Nährstoffmangel (Kalorienrestriktion) aktiviert jedoch die nicht-selektive Makroautophagie. Während längerem Fasten (offenbar ab dem dritten Tag nach der letzten Mahlzeit) wechselt diese allmählich zu CMA.
Die Funktion von CMA sowie der Makroautophagie nimmt mit dem Alter ab und kann teilweise durch oxidativen Stress aktiviert werden. Die Aktivität der 20 bis 30% der Lysosomen, die unter Nahrungsaufnahme mit CMA funktionieren, steigt nach drei Tagen Fasten auf 60 bis 80% an (Forschung an Rattenleberzellen). Mit zunehmendem Alter verlangsamt sich der Abbau aller Proteine, was zur Ansammlung veränderter oder geschädigter Proteine führt. Dies geht mit einer Abnahme des CMA-Prozesses einher.
Gibt es neben dem Fasten noch andere Methoden, um die Makroautophagie und die CMA zu beschleunigen?
Sport kann die Translation bestimmter Chaperon-Proteine (z. B. Hsp-72) steigern und die Expression nimmt bei zunehmenden oxidativen, thermischen, hypoxischen/hyperoxischen und physischen Gewebeschäden zu.
Dieser Anstieg wurde in Leber, Herz, Leukozyten usw. beobachtet, nachdem die Skelettmuskulatur aktiviert wurde. Die Aktivierung erfolgt über Nebenprodukte des Muskelstoffwechsels (Laktate, Radikale und Glukosemangel) sowie die Aktivierung von Stresshormonen. Das bereits erwähnte Hsp-72 wirkt ähnlich wie andere Chaperone und beeinflusst den Abbau von Proteinen im Zytoplasma sowie die Aufrechterhaltung der zellulären Proteinhomöostase. Es scheint, dass die durch Sport induzierte Menge mit dem Ausmaß der Stoffwechselschäden korreliert, denen das Gewebe ausgesetzt ist, und dass sie zusätzlich durch Sport in der Hitze reguliert wird.
Eine erhöhte Expression von Hsp72 in der Skelettmuskulatur soll vor Alterungserscheinungen schützen. Bei Kalorienrestriktion nimmt sie jedoch nicht zu (im Gegensatz zur Hsp90-Proteinexpression).
Es scheint, dass sich Chaperonproteine, die an der Stressreaktion auf körperliche Betätigung beteiligt sind, von denen unterscheiden, die an autophagischen Prozessen aufgrund von Kalorienrestriktion beteiligt sind.

Schlussfolgerungen – Wie und wann sollte man fasten?
Die Themen Langlebigkeit und Autophagie sind äußerst komplex, insbesondere, wenn wir uns mit der Funktionsweise langlebiger Prozesse auf zellulärer Ebene befassen. Wir hoffen, dass wir Ihnen dieses komplexe Thema verständlich näherbringen konnten – nachfolgend haben wir die wichtigsten Punkte für Sie zusammengefasst:
- Im Gegensatz zu unseren Vorfahren oder unseren Zeitgenossen in Kriegsgebieten haben wir das Glück, Strategien und Interventionen zur Verlängerung von Leben und Gesundheit erforschen zu können, ohne an das Überleben denken zu müssen.
- Sowohl wissenschaftliche Erkenntnisse als auch praktische Erfahrung zeigen uns heute: Der wahre „Jungbrunnen“ liegt nicht in Nahrungsergänzungsmitteln oder kurzlebigen Gesundheitstrends, sondern in der Erhaltung von Muskelmasse und körperlicher Stärke. Ein ausgewogenes Verhältnis von Muskel- und Fettmasse ist einer der wirksamsten Schlüssel zu einem langen, gesunden Leben.
- Erst wenn wir einen „gesunden“ Körperfettanteil erreicht haben, ist es sinnvoll, zusätzliche Effekte des internen „Recyclings“ zu erforschen, beispielsweise durch Nahrungsverzicht (Wasserfasten). Die Prioritäten sind klar! Die „Autophagie“ zur Gewichtsabnahme anzuwenden, ist eine fehlgeschlagene Strategie!
- Yoshinori Ohsumi machte das Konzept der Autophagie mit einem wohlverdienten Nobelpreis einer breiten Öffentlichkeit zugänglich. Wie viele nützliche Dinge wurde auch dieser Begriff durch unbegründetes Marketing „prostituiert” und in einen nicht vorhandenen Zusammenhang gebracht, beispielsweise mit einem zeitlich begrenzten Ernährungsprotokoll wie 16-8, das in der Populärliteratur fälschlicherweise als intermittierendes Fasten bezeichnet wird.
- Autophagie ist (glücklicherweise) in jedem Moment unseres Lebens aktiv. Ihre Geschwindigkeit und Kraft nehmen mit dem Alter zwar ab, aber es gibt Instrumente und Interventionen, mit denen wir sie deutlich beschleunigen können. Diese Interventionen beziehen sich in erster Linie auf bestimmte Praktiken im Zusammenhang mit Ernährung und körperlicher Aktivität. Solange wir unter 30 Jahre alt sind, besteht daher kein Bedarf an Interventionen zur Beschleunigung der Autophagie. Wir sollten uns stattdessen auf eine gesunde Körperzusammensetzung konzentrieren, unsere Muskelmasse erhalten oder aufbauen und gleichzeitig unseren Fettanteil kontrollieren.
- 16 Stunden sind jedoch nicht ausreichend, um die Autophagieprozesse im menschlichen Körper signifikant zu beschleunigen. Aus praktischen Gründen ist es unmöglich, dies an Menschen zu testen. Aus anekdotischen Beobachtungen und Erkenntnissen, die aus der Forschung abgeleitet wurden, können wir jedoch schließen, dass sich die Prozesse mindestens 36 Stunden nach der letzten Mahlzeit beschleunigen und die sogenannte „tiefe“ Chaperon-Autophagie drei volle Tage (72 Stunden) nach der letzten Mahlzeit stattfindet.
- Zu langes Fasten wirkt sich negativ auf die Muskelmasse aus, die wir möglichst erhalten möchten. Offensichtlich genügen bereits drei bis fünf Tage für ein vollständiges Fasten, sofern dies ärztlicherseits genehmigt wurde. Bei kürzeren Fastenzeiten wird die tiefgreifende Autophagie vermutlich nicht ausreichend aktiviert. Längere Fastenphasen können hingegen das Muskelgewebe messbar belasten.
- Da bekanntlich die Dosis das Gift macht, sollte man es nicht übertreiben. Ein solches „Window“ alle drei Monate ist völlig ausreichend. An allen anderen Tagen des Jahres bzw. des Lebens liegt der Fokus auf einer nährstoffreichen Ernährung und körperlicher Aktivität, die sich auf die Muskelfitness konzentriert, wobei die kardiorespiratorische Fitness, insbesondere die maximale Sauerstoffaufnahme (VO₂max), nicht vernachlässigt werden sollte.
- Für mehrtägige Fastenzeiten sollten Sie sich gut aufwärmen und vorbereiten, indem Sie ein 36-stündiges Fasten praktizieren. Am einfachsten ist eines, das zwei Nächte und einen Tag ohne Essen umfasst.
Dieser Text dient ausschließlich Informationszwecken und bietet einen Überblick über die wissenschaftliche Literatur zu diesem Thema. Er ist weder ein Aufruf zum Fasten noch eine Marketingbotschaft. Konsultieren Sie vor jeder geplanten Intervention einen Arzt und einen Experten auf diesem Gebiet.
Melden Sie sich für unseren Newsletter an, um weitere gesunde Tipps zu erhalten, und sichern Sie sich 10% Rabatt auf Ihre erste Bestellung! ![]()
Das könnte Sie auch interessieren...
Bio-Fabrik
Verfügbare Zahlungsmethoden
Alle Transaktionen sind geschützt und erfolgen über sichere Zahlungssysteme. Sie können aus folgenden Zahlungsmethoden wählen:
- Barzahlung bei Lieferung
- Kartenzahlung
- Banküberweisung (Zahlschein/Vorkasse)
- Online-Banking
- Google Pay

- Apple Pay
Unsere Läden
- Zagreb - Malešnica
- Zagreb - Shopping Center Point
- Zagreb - Vlaška
- Zagreb - Rudeš
- Zagreb - Dubrava
- Zagreb - Kvatrić
- Zagreb - Martinovka
- Zagreb - Z Centar
- Zagreb - Ilica
- Zagreb - Bundek
- Zagreb - Lanište
- Zagreb – Travno
- Split - Shopping Center Mall of Split
- Split - Centar
- Rijeka - Tower centar
- Rijeka - Riva
- Varaždin - Zentrum
- Pula - Shopping Center Max City
- Zadar - Supernova centar
- Osijek